Publié le
Lecture 9 mins
L’oesophagite à éosinophiles chez le jeune enfant en 2011. Réflexions à propos de 3 observations
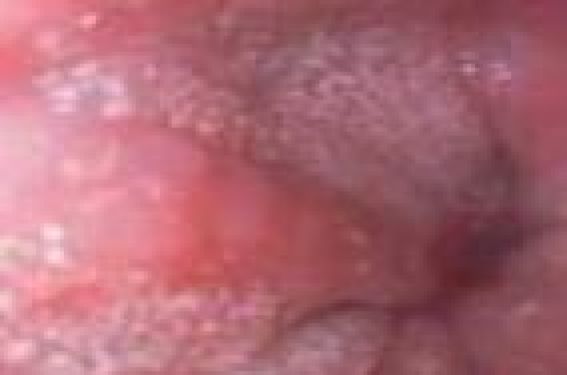
L’oesophagite à éosinophiles, reconnue chez l’enfant dans les années 80, est de diagnostic de plus en plus fréquent, grâce au recours à une fibroscopie oeso-gastro-duodénale complète, c’est-à-dire comportant des biopsies oesophagiennes systématiques. Les trois observations que nous présentons ici, parmi plus de dix cas répertoriés récemment, attirent l’attention...
P. MOLKHOU, J.-C. WAGUET, Faculté René Descartes, Paris ; Hôpital Saint-Vincent-de-Paul, Paris Illustration/Figure 1. : Endoscopie oesophagienne : trachéalisation. L’oesophagite à éosinophiles, reconnue chez l’enfant dans les années 80, est de diagnostic de plus en plus fréquent, grâce au recours à une fibroscopie oeso-gastro-duodénale complète, c’est-à-dire comportant des biopsies oesophagiennes systématiques. Les trois observations que nous présentons ici, parmi plus de dix cas répertoriés récemment, attirent l’attention, non seulement sur certaines différences avec les données classiques, mais encore sur la méconnaissance de cette affection et sur la difficulté du diagnostic porté souvent tardivement. C’ est en 1981 que l’oesophagite à éosinophiles (OEE), pathologie émergente au cours de ces dernières années, a été décrite pour la première fois chez l’enfant. Mais, en réalité, les études cliniques qui ont conduit à l’associer puis à la différencier du reflux gastro-oesophagien (RGO) remontent à 1995 avec la publication de l’équipe pédiatrique de K.J. Kelly et H.A. Sampson (Johns Hopkins University, États-Unis)(1). Ces auteurs remarquèrent que le traitement classique du RGO était sans effet, même après intervention chirurgicale, chez 12 enfants diagnostiqués préalablement RGO et dont l’oesophage était infiltré d’éosinophiles, ce qui n’est pas le cas d’un oesophage sain. Un traitement avec une formule à base d’amino-acides (Neocate®) fut institué au départ pendant un minimum de 6 semaines, période au cours de laquelle furent notées soit une résolution, soit une amélioration des symptômes, ainsi qu’une diminution significative du compte des éosinophiles. Dès la réintroduction de l’aliment, tous les symptômes réapparurent, d’où l’hypothèse d’une possible allergie alimentaire. L’OEE est caractérisée par l’accumulation histopathologique dans l’oesophage de plus de 15 polynucléaires éosinophiles intraépithéliaux par champ au fort grossissement, associée à une symptomatologie à expression digestive et respiratoire haute résistant en principe aux inhibiteurs de la pompe à protons (IPP). Observations Cas n°1 Graham G…, né le 9 décembre 2000, présente un syndrome des allergies alimentaires multiples : lait de vache, soja, arachide, farine de blé, à expression dermo-respiratoire. À 5 ans, malgré des mesures d’éviction appropriées suivies depuis la prime enfance, asthme et eczéma subsistent ; leur sont associées un état général médiocre, des otites, rhinopharyngites et laryngites fréquentes. Une pH-métrie et une fibroscopie oeso-gastro-duodénale (FOGD) sont donc réalisées, l’une objectivant un reflux diurne et nocturne sévère, l’autre une oesophagite à éosinophiles (OEE) à 40 éléments par champ au 40e. Un traitement par montelukast et IPP est institué : 6 mois plus tard, la fibroscopie de contrôle est normale. Au cours des 2 années suivantes, le traitement est poursuivi et, progressivement, la croissance staturo-pondérale et l’appétit sont normalisés, les problèmes ORL disparaissent ; seules persistent une xérose étendue, et à l’EFR, une hyperréactivité bronchique modérée. À 9 ans, l’alimentation est normalisée et le traitement arrêté. Cas n°2 Lucas G…, né le 16 juillet 2003, a présenté un RGO néonatal non exploré, une dermatite atopique (DA) apparue à 3 mois puis, sur un mode récurrent, toux de décubitus, infections ORL, épigastral gies, éructations. À 3 ans, on note une sensibilisation aux acariens, au chat, chien, cheval, l’absence de sensibilisations alimentaires. Un traitement d’épreuve par IPP du RGO supposé se révèle efficace en 3 mois, suivi, à son arrêt, d’une récidive immédiate. Une pH-métrie et une fibroscopie sont alors pratiquées, qui objectivent un RGO modéré diurne d’une part, une OEE à éosinophiles à 30 éléments par champ au 40e, d’autre part. Le traitement associe IPP, montelukast et corticothérapie inhalée. À 5 ans, la FOGD montre une réduction de l’OEE à 15 éléments par champ, il existe une duodénite à éosinophiles ; l’EFR objective un syndrome obstructif. Progressivement, sous le même traitement, la symptomatologie ORL, respiratoire et digestive s’amende, l’appétit s’améliore. À 7 ans et demi, la situation est asymptomatique, la FOGD et l’EFR sont normales ; le traitement est arrêté, une désensibilisation aux acariens est entreprise. Cas n°3 Camille B…, née le 8 août 2005, a présenté dès la naissance une intolérance aux protéines du lait de vache (IPLV) à expression digestive, traitée par hydrolysat poussé. Un Diallertest® est positif à 5 mois et le Neocate® lui est substitué, associé à une diversification restreinte du fait de sensibilisations multiples avec IgE élevées pour blanc d’oeuf (BO), arachide et blé. Au cours des mois suivants, on note une DA des plis, une toux épisodique avec wheezing, des épisodes infectieux ORL et respiratoires, et un traitement d’épreuve par IPP du RGO supposé est institué. À 14 mois, survient une réaction pré-anaphylactique à l’ingestion intempestive de pain. Une FOGD pratiquée à 16 mois objective une hernie hiatale et une OEE à 30 éléments par champ : le régime exclut le lait de vache, le blanc d’oeuf, l’arachide, les fruits à coque et le blé ; le traitement comporte IPP et montelukast à 2,5 mg par jour. À 22 mois, la FOGD confirme l’OEE à 40 éléments/ champ ; on introduit une corticothérapie inhalée. À 28 mois, la courbe staturo-pondérale est altérée, l’appétit médiocre, la FOGD confirme l’OEE. Une corticothérapie orale est tentée, mais se révèle mal tolérée. Figure 2. Endoscopie oesophagienne : dépôts et taches blanchâtres. À 40 mois, l’EFR objective une hyperréactivité bronchique (HRB) majeure à la métacholine ; le retard staturo-pondéral persiste, les infections ORL et respiratoires se succèdent nécessitant une kinésithérapie respiratoire régulière. À partir de 4 ans, les sensibilisations alimentaires diminuent, la croissance repart et l’incidence des problèmes infectieux régresse. À 5 ans et demi, la FOGD objective une béance cardiale modérée, une réduction significative de l’OEE à 15 éléments. L’EFR montre une HRB très modérée. Les taux d’IgE spécifiques sont stables, les évictions sont maintenues pour le lait de vache, le blanc d’oeuf, le blé et l’arachide. Le traitement comporte IPP et corticothérapie inhalée. Commentaires L’histoire naturelle de l’OEE chez l’enfant semble être celle d’un RGO évoluant sur un terrain atopique. Quelle que soit l’expression de ce RGO – digestive, ORL (infections récidivantes), respiratoire (signes d’hyperréactivité bronchique : HRB) –, cette symptomatologie résiste immédiatement ou progressivement au traitement par IPP, ainsi qu’aux mesures d’éviction appropriées aux éventuelles sensibilisations alimentaires. La fibroscopie digestive est alors envisagée en première ou seconde intention parce que, chez un enfant incontestablement atopique, le tableau clinique est évocateur d’un RGO demeurant actif. À la différence de certaines données de la littérature, il apparaît clairement que les sensibilisations alimentaires, quand elles existent, ne seraient pas le déterminant primaire de l’OEE, puisque dans nos observations l’éviction des aliments en cause a été sans effet ; il semblerait en être de même des éventuelles sensibilisations aéroallergéniques (acariens, pollens). L’OEE serait alors le marqueur du terrain atopique au niveau d’un tissu cible parce que fragilisé par le RGO. Figure 3. Endoscopie oesophagienne : signe du papier crêpé de la muqueuse. Les guérisons constatées sont certainement le fruit combiné d’une évolution spontanée et des thérapeutiques anti-inflammatoires (corticothérapie inhalée et/ou montelukast). Quant au bien-fondé de l’utilisation des IPP, souvent considérés comme inefficaces dans le traitement de l’OEE, il nous a semblé justifié dans deux de nos observations par l’existence de reflux acides confirmés par la pH-métrie. Symptomatologie de l'oesophagite à éosinophiles chez l’enfant : que dit la littérature ? (2-5,9,10) Alors que chez l’adulte, la symptomatologie dominante est la dysphagie à l’ingestion des aliments solides, associée à des douleurs épigastriques et thoraciques, chez l’enfant, elle manque de spécificité, pouvant associer douleurs abdominales, nausées, vomissements, toux, infections ORL (otites) récurrentes et retard de croissance. On y constate en outre, dans près de 50 % des cas, la présence d’asthme, allergies alimentaires et rhino-conjonctivites allergiques ; on estime aussi que 8 à 10 % des enfants suivis pour RGO seraient porteurs d’OEE, et que l’allergie alimentaire en serait la cause principale (les sensibilisations le plus souvent en cause étant le lait de vache, l’oeuf, le blé et le soja). On estime que 8 à 10 % des enfants suivis pour RGO seraient porteurs d’une oesophagite à éosinophiles. Figure 4. Biopsie d’une oesophagite à éosinophiles. Lors de la FOGD, l’examen macroscopique est souvent normal mais, parfois, on observe des anomalies caractéristiques : lésions blanchâtres, signes de trachéalisation ou de papier crêpé (figures 1, 2 et 3). Le diagnostic final est en fait affirmé lors de l’examen microscopique des prélèvements oesophagiens biopsiés, reposant sur l’existence d’un taux de polynucléaires éosinophiles supérieur à 15 éléments par champ au 40e (figures 4 et 5). Physiopathologie La physiopathologie de l’OEE, encore mal connue, pourrait, d’après de récentes études, correspondre à une réponse immunitaire à des allergènes exogènes, alimentaires ou aéroallergéniques. Cette réponse serait médiée par les lymphocytes Th2, avec une augmentation des médiateurs pro-inflammatoires (interleukine 4, 5, 13 et éotaxine 3) recrutant les éosinophiles. Il en résulterait une infiltration de la muqueuse oesophagienne par des cellules exprimant l’interleukine 5 (IL-5) et une hypersécrétion de TNFα (tumor necrosis factor α) par les cellules de l’épithélium pavimenteux oesophagien. Très récemment, des chercheurs de l’Institut national américain des allergies et maladies infectieuses (NIAID) ont
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :